Imagerie nanométrique
Une équipe internationale de chercheur a franchi un cap technologique en parvenant à observer en direct des interactions entre des métaux et des cellules vivantes à l’échelle nanométrique1. Grâce à une technique d’imagerie inédite par rayons X, cette avancée ouvre la voie à une meilleure compréhension des liens entre les métaux et le vivant, depuis le fonctionnement des métallomédicaments jusqu’au comportement des nanoparticules dans les organismes.
Il est désormais possible d’observer le fer en action au cœur d’une cellule vivante ! Des chercheurs du BIAM, en collaboration avec l’Institut Max Planck (Colloïdes et interfaces, Potsdam, Allemagne) et les synchrotrons de Diamond Light Source au Royaume-Uni et de Soleil au Saclay, ont mis au point pour cela une approche innovante permettant de cartographier des métaux dans des micro-organismes vivants.
En quoi la cartographie des métaux dans des micro-organismes vivants est-il important ?
Dans le fonctionnement du vivant – plus précisément dans les dynamiques métal-biologie, les métaux jouent un rôle aussi essentiel que mal compris. Par exemple, certaines bactéries sont capables de produire naturellement des nanoparticules magnétiques composées de magnétite (Fe₃O₄), qui leur servent de boussole pour s’orienter dans leur environnement. De nombreux autres organismes utilisent des métaux pour produire des minéraux nanoscopiques, qui peuvent jouer un rôle biologique et avoir un impact sur le cycle des métaux dans l’environnement. « Jusqu’à présent, les techniques d’imagerie ne permettaient pas d’observer ces mécanismes en temps réel : elles manquaient de résolution ou nécessitaient des conditions artificielles, rendant invisibles ces dynamiques fines », précise Daniel Chevrier, chargé de recherche CNRS au sein du BIAM et auteur principal de cette toute nouvelle approche d’imagerie.
Une collaboration internationale pour observer le fer à l’état natif
Pour lever ces verrous technologiques, les chercheurs ont uni leurs expertises : le BIAM pour son savoir-faire en biologie des micro-organismes, l’Institut Max Planck pour la conception d’un dispositif microfluidique, et les synchrotrons Diamond et Soleil pour leurs outils d’imagerie de pointe. Ensemble, ils ont réussi à observer la formation de nanoparticules de magnétite dans des bactéries vivantes en mesurant la quantité de fer dans les cellules individuelles au fil du temps.
Un dispositif inédit pour observer des cellules vivantes
Cette prouesse repose sur deux innovations complémentaires : La première est une nanosonde à rayons X, un faisceau d’une extrême finesse produit par le synchrotron, capable de détecter la présence de métaux à très petite échelle. La seconde est une cellule liquide, conçue pour maintenir les bactéries en vie tout au long de l’observation. Contrairement aux méthodes classiques, qui imposent souvent de figer ou d’assécher les échantillons, cette cellule microfluidique offre un environnement stable, proche des conditions naturelles, tout en résistant à l’intensité des rayons X. Grâce à ce dispositif unique, les chercheurs ont pu suivre la dynamique du fer dans des bactéries magnétotactiques, pendant plusieurs heures.

Dispositif microfluidique sur mesure pour la microscopie nano-XRF.
(A) Schéma de fabrication de la couche microfluidique.
(B) Dispositif assemblé avec connexions et design des microcanaux (vue de côté en encadré).
(C) Image au microscope optique du dispositif installé sur la plateforme de balayage, avec les zones d’analyse XRF indiquées en jaune. (D, E) Cartes de la répartition du fer (signal Fe Kα) dans des bactéries, obtenues avec un pas de 150 nm (D) et 200 nm (E). L’échelle des couleurs reflète l’intensité du signal XRF. Barres d’échelle : 100 μm (C), 3 μm (D), 5 μm (E).
Fort de ce succès, l’équipe s’est maintenant tournée vers les coccolithophores : des microalgues capables de fabriquer des coquilles de carbonate de calcium. Cela permet de mieux comprendre la biominéralisation intracellulaire en réalisant des expériences dirigées en milieu liquide.2
Pourquoi les synchrotrons sont au cœur de cette découverte
Longtemps, l’étude des métaux dans les cellules vivantes a été freinée par le manque d’outils capables de les observer dans des conditions proches du réel. Or, les synchrotrons – ces grandes installations produisant des rayons X ultra-intenses – ouvrent aujourd’hui un nouveau champ d’exploration. Elles permettent de suivre, à l’échelle nanométrique, la façon dont les métaux interagissent avec les systèmes biologiques, dans un environnement liquide, donc compatible avec la vie cellulaire.
« C’est un saut qualitatif : on peut enfin observer des cellules vivantes sans les figer, tout en détectant des quantités infimes de métaux » s’enthousiasme le scientifique. Cette capacité inédite offre en effet des perspectives considérables pour les sciences de la vie mais aussi l’écotoxicologie ou la médecine, en fournissant des données proches du comportement réel des organismes. De quoi affiner les modèles, valider les hypothèses… et ouvrir la voie à des innovations durables.
Des applications prometteuses pour la santé et l’environnement
L’approche expérimentale présentée dans ce travail ouvre la voie à des avancées significatives dans plusieurs domaines de recherche. En particulier, elle pourrait permettre une meilleure compréhension des mécanismes complexes liés à l’action des métallodrogues (composés métalliques utilisés pour traiter certaines pathologies) ainsi que la manière dont les cellules absorbent et dégradent les nanoparticules. Ces dernières années, les nanoparticules ont suscité un grand intérêt pour leur potentiel thérapeutique, mais leur impact à long terme sur les organismes et l’environnement reste encore flou. Cette nouvelle méthode d’imagerie pourrait enfin permettre d’évaluer l’état de ces nanoparticules (i.e., composition, taille) dans des milieux complexes de mieux comprendre leur distribution et leur devenir dans les systèmes vivants.
De plus, la biominéralisation des tissus durs, tels que les os, les dents ou encore les coquilles de certaines espèces marines, pourrait être étudiée en profondeur grâce à la possibilité d’observer la formation de ces structures à l’échelle nanométrique. Ces avancées promettent ainsi de nouveaux outils pour les chercheurs en biologie, chimie et sciences de l’environnement, avec des implications majeures pour la médecine et l’écotoxicologie.
En résumé
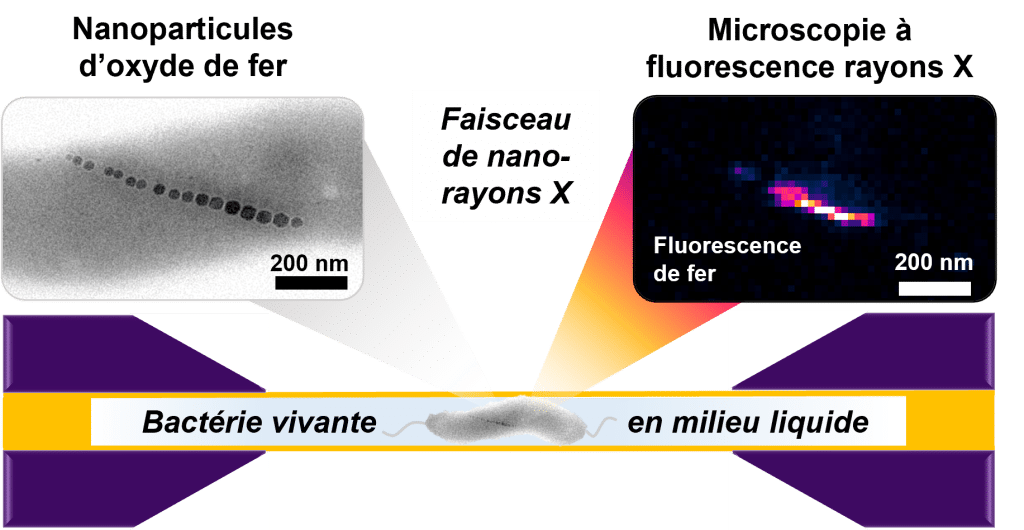
Représentation schématique de l’imagerie par fluorescence rayons X d’une bactérie magnétotactique vivante dans une cellule liquide.
L’image de microscopie électronique à transmission (en haut, à gauche) montre la chaîne de nanoparticules d’oxyde de fer d’une bactérie séchée comme exemple représentative. L’image de fluorescence rayons X (en haut, à droite) montre le signal provenant du fer dans une bactérie vivante.
References
- M. Chevrier, E. Cerdá-Doñate, L. Gandarias, M. A. Gomez Gonzalez, S. Swaraj, P. E. D. SOTO RODRIGUEZ, A. Fraisse, T. Robinson and D. Faivre, Chem. Sci., 2025, Edge Article, DOI: 10.1039/D4SC08375J
- M. Chevrier, S. Gautam, A. Scheffel, Faraday Discuss., 2025 Advance Article, DOI: 10.1039/D5FD00021A