Après vingt ans de recherches sur les bactéries Deinococcus, réputées pour leur résistance exceptionnelle aux radiations et à la dessiccation, le BIAM célèbre une reconnaissance internationale : l’enzyme IrrE, régulateur indispensable à la survie cellulaire après des stress intenses, fait son entrée dans l’ouvrage de référence mondial sur les peptidases. Cette distinction met en lumière l’importance de la recherche fondamentale et ouvre de nouvelles perspectives en microbiologie, radiobiologie et biotechnologie.
À l’invitation de l’éditeur Neil Rawlings, Arjan de Groot et Laurence Blanchard, chercheurs du BIAM, ont rédigé un chapitre retraçant vingt ans de découvertes sur l’enzyme IrrE, depuis la caractérisation de la bactérie radiotolérante Deinococcus deserti en 2005 – dans laquelle elle est présente – jusqu’à la compréhension complète de son mécanisme d’action, rendue possible par l’identification de son substrat, le répresseur transcriptionnel DdrO. Cette reconnaissance symbolise l’aboutissement d’un travail de longue haleine impliquant également plusieurs doctorants et ingénieurs, et met en lumière l’originalité fonctionnelle de IrrE, aujourd’hui considérée comme le prototype d’une nouvelle famille de régulateurs bactériens impliqués dans diverses réponses au stress.
Une enzyme clé de la résistance extrême
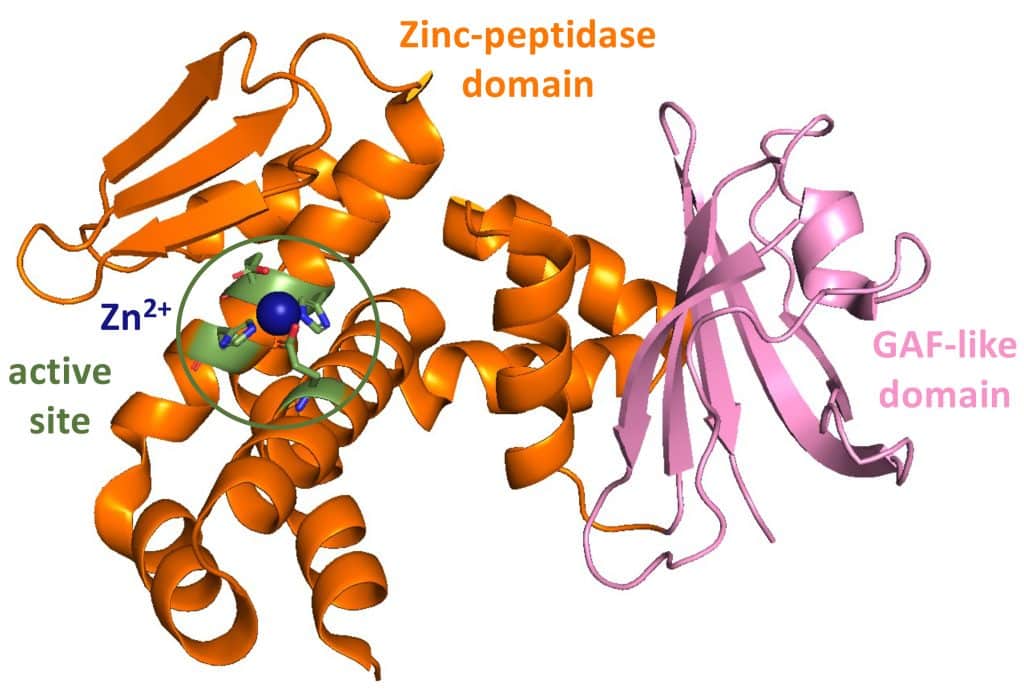
Depuis sa découverte initiale en 2002 chez Deinococcus radiodurans par une équipe américaine, et grâce aux travaux menés au sein du BIAM par les deux scientifiques, IrrE s’est imposée comme une métallopeptidase régulatrice essentielle, orchestrant la réponse cellulaire aux radiations et à la dessiccation. La détermination de sa structure cristallographique en 2009 en collaboration avec l’IBS de Grenoble, la découverte de son substrat, le répresseur DdrO en 2014, et l’élucidation progressive de son mécanisme moléculaire entre 2017 et 2025 ont permis de positionner le couple IrrE/DdrO comme référence pour une nouvelle famille de régulateurs bactériens.
Le mécanisme d’action est désormais bien établi : En réponse aux radiations ou à la dessiccation qui endommagent l’ADN, IrrE s’active et clive DdrO, entrainant son inactivation. Cette étape déclenche alors l’expression de gènes de réparation de l’ADN, assurant ainsi la survie des cellules.
Homologues bactériens d’IrrE : nouvelles pistes et applications
Des homologues d’IrrE ont été identifiés dans de nombreuses bactéries, qu’elles soient environnementales, pathogènes ou utilisées dans l’industrie. Leur étude pourrait éclairer des mécanismes de tolérance aux antibiotiques, moduler la survie de micro-organismes pathogènes ou optimiser des souches bactériennes utilisées en bioproduction sous stress. Cette découverte met en lumière l’importance de la recherche fondamentale pour révéler des mécanismes clés de survie cellulaire et ouvre la voie à de nouvelles collaborations nationales et internationales impliquant le CEA et le CNRS avec d’autres partenaires.
Un modèle inspirant, du fondamental à l’applicatif
IrrE illustre parfaitement comment l’étude d’un organisme modèle peut produire un impact scientifique majeur, tout en inspirant des pistes innovantes pour la microbiologie appliquée, la radiobiologie et la biotechnologie industrielle. Cette reconnaissance, par l’inclusion de l’enzyme IrrE dans un ouvrage de référence international, ouvre de nouvelles perspectives pour la recherche sur la réponse au stress chez les bactéries et pour le développement de collaborations scientifiques et partenariats stratégiques.
Références et auteurs
De Groot A.* & Blanchard L. (2025) IrrE peptidase (Deinococcus sp.). Handbook of Proteolytic Enzymes. Metallopeptidases. 4th edition, Chapter 84 – pages 587-590.
Références principales, faits marquants, communiqué de presse et reportage associés
2005 – de Groot A*, Chapon V, Servant P, Christen R, Fischer-Le Saux M., Sommer S., Heulin T. (2005) Deinococcus deserti sp. nov., a gamma-radiation-tolerant bacterium isolated from the Sahara Desert. Int J Syst Evol Microbiol. 55, 2441–2446. DOI: 10.1099/ijs.0.63717-0
2009 – de Groot A*, Dulermo R, Ortet P, Blanchard L, Guérin P, Fernandez B, Vacherie B, Dossat C, Jolivet E, Siguier P, Chandler M, Barakat M, Dedieu A, Barbe V, Heulin T, Sommer S, Achouak W, Armengaud J. (2009) Alliance of proteomics and genomics to unravel the specificities of Sahara bacterium Deinococcus deserti. PLoS Genetics 5(3):e1000434.2009. DOI: 10.1371/journal.pgen.1000434
2009 – Vujičić-Žagar A, Dulermo R, Le Gorrec M, Vannier F, Servant P, Sommer S., de Groot A, Serre L.* (2009) Crystal Structure of the IrrE Protein, a Central Regulator of DNA Damage Repair in Deinococcaceae. J. Mol. Biol. 386, 704–716. DOI: 10.1016/j.jmb.2008.12.062
2014 – Ludanyi M1, Blanchard L.1, Dulermo R, Brandelet G, Bellanger L, Pignol D, Lemaire D, de Groot A* (2014). Radiation response in Deinococcus deserti: IrrE is a metalloprotease that cleaves repressor protein DdrO. Mol. Microbiol. 94(2):434-49. DOI: 10.1111/mmi.12774
Fait marquant CEA : Comment Deinococcus résiste à tout
2017 – Blanchard L, Guérin P, Roche D, Cruveiller S, Pignol D, Vallenet D, Armengaud J, de Groot A*. (2017) Conservation and diversity of the IrrE/DdrO-controlled radiation response in radiation-resistant Deinococcus bacteria. MicrobiologyOpen 6(4) :e00477. DOI: 10.1002/mbo3.477
2019 – Lim S, Jung J-H, Blanchard L, de Groot A* (2019). Conservation and diversity of radiation and oxidative stress resistance mechanisms in Deinococcus species. FEMS Microbiology Reviews 43(1):19-52. DOI: 10.1093/femsre/fuy037
Communiqué de presse : Les ressources insoupçonnées de la nature pour résister aux radiations
2019 – de Groot A, Siponen MI, Magerand R, Eugénie N, Martin-Arevalillo R, Doloy J, Lemaire D, Brandelet G, Parcy F, Dumas R, Roche P, Servant P, Confalonieri F, Arnoux P, Pignol D, Blanchard L.* (2019)Crystal structure of the transcriptional repressor DdrO : insight into the metalloprotease/repressor-controlled radiation response in Deinococcus. Nucleic Acids Res. 47(21):11403-11417. DOI: 10.1093/nar/gkz883
Fait marquant CNRS et CEA : Radiotolérance bactérienne : une régulation haute couture !
2021 – Blanchard L., de Groot A.* (2021) Coexisence of the SOS-dependent and SOS-independent regulation of DNA repair genes in radiation-resistant Deinococcus bacteria. Cells 10, 924. DOI: 10.3390/cells10040924
2021 – Magerand R, Rey P, Blanchard L., de Groot A.* (2021) Redox signalling through zinc activates the radiation response in Deinococcus bacteria. Sci Rep 25;11(1):4528. DOI: 10.1038/s41598-021-84026-x
Fait marquant CNRS (INSB DR12) : Radiorésistance bactérienne : le zinc, un métal précieux !
Fait marquant CEA (DRF et BIAM) : La radiorésistance bactérienne s’organise avec le zinc
2026 – Reuzeau A1, Reille O1, Malesinski S, Barré T, Lemaire D, Allemand F, Sibille N, de Groot A*, Blanchard L.* (2026) Radiation-response in Deinococcus bacteria: characterization of the transient IrrE-DdrO heterodimer complex. FEMS Microbes (in press) DOI: 10.1093/femsmc/xtag001