Vous êtes ici : Accueil Cité des Énergies > ACCUEIL BIAM > Plateformes technologiques > HélioBiotec – Microalgues > Offre de compétences et équipements
Expertise et instrumentation

Responsable : Bertrand Légeret (IEHC CNRS)
HelioBiotec dispose de tous les équipements nécessaires à l’analyse des lipides microalgaux (glycérolipides membranaires ou de stockage) ainsi que d’autres types de lipides (hydrocarbures, pigments, polyesters lipidiques et cires végétales).
Types de lipides analysés :
– Glycérolipides : phospholipides, galactolipides, sulfolipides, mono-, di- et tri-acylglycérols, lipides de bétaïne.
– Acides gras : espèces communes et inhabituelles
– Composants des cires cuticulaires végétales : alcanes, alcools primaires et secondaires, aldéhydes, cétones, monoesters, etc.
– Monomères des polyesters de la cutine et de la subérine : acides gras hydroxylés, acides gras époxydés, acides gras dicarboxyliques, etc.
– Hydrocarbures : alcanes et alcènes.
– Pigments : chlorophylles, caroténoïdes.
Équipement analytique :
– Chromatographie en phase gazeuse couplée à un spectromètre de masse et/ou un détecteur à ionisation de flamme (GC-MS/FID) : 1 GC-MS (TRACE-DSQ Thermo), 1 GC-MS/FID avec préparation automatique des échantillons (Agilent), 1 GC-MS/FID (Agilent) avec thermodésorbeur (Gerstel).
– Chromatographie sur couche mince haute performance (HPTLC) : 1 Camag TLC autosampler 4
– Chromatographie liquide couplée à la spectrométrie de masse (UPLC-MS/MS) : 1 QTOF (Triple TOF 5600 AB SCIEX), 1 Orbitrap (Q Exactive Thermo).
Analyse des glycérolipides:
- Les différents niveaux d’analyse
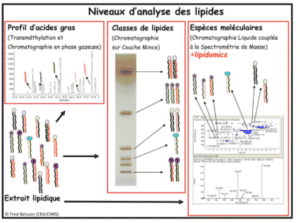
- Analyse de la composition en acides gras par GC-MS/FID
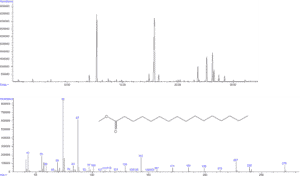
© B. Légeret / CEA
- Analyse des classes de lipides par HPTLC
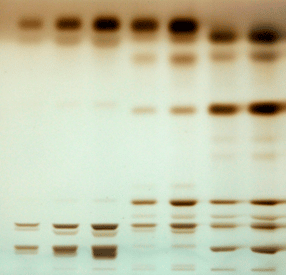
© C. Cuiné / CEA
- Analyse des espèces de molécules lipidiques par UPLC-MS/MS – lipidomique
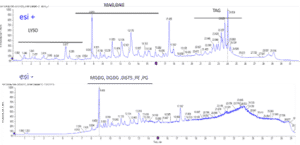
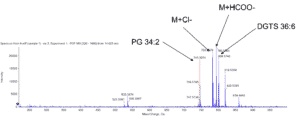
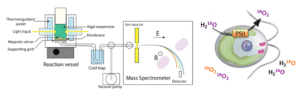
La plateforme HelioBiotec est équipée de deux spectromètres de masse dédiés à l’analyse des gaz d’intérêt biologique et plus particulièrement l’oxygène, l’hydrogène et le dioxyde de carbone.
La spectrométrie de masse permet de suivre en temps réel la composition de l’atmosphère (gazeuse ou dissoute) au contact d’un échantillon biologique : cellules vivantes (microalgues, bactéries, cellules isolées…) ou extrait enzymatique. Cette technique est utilisée pour caractériser les échanges photosynthétiques d’oxygène ou de dioxyde de carbone ou la photo-production d’hydrogène chez les microalgues ou les cyanobactéries. Elle permet de déterminer les flux unidirectionnels (absorption d’oxygène par la lumière) grâce au suivi d’espèces gazeuses marquées par des isotopes stables.
Les gaz dissous contenus dans la cellule d’analyse (volume utile d’environ 2 mL) diffusent à travers une membrane en téflon, puis transitent par une ligne de vide vers la source d’ions du spectromètre de masse. Cette technique permet d’analyser en temps réel les échanges gazeux de différents types de matériaux biologiques (microalgues, bactéries, enzymes, etc.). La suspension peut être éclairée soit en lumière blanche apportée par fibre optique, soit en lumière verte par 3 LEDs distribuant uniformément l’éclairement. Le parc est composé d’un analyseur quadripolaire PrismaPlus (Pfeiffer Vacuum) et d’un analyseur de secteur magnétique Prima dB (Thermo Scientific).
Afin de sélectionner les souches d’intérêt, le laboratoire a développé trois méthodes de criblage. La première évalue la teneur en huile, la seconde discrimine sur la composition lipidique, la troisième sur l’activité photosynthétique de l’organisme.
- Cribles de mutants basés sur la teneur en huile cellulaire

- Cribles de mutants basés sur la composition en acides gras
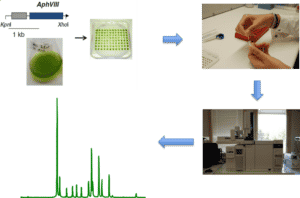
- Cribles de mutants basés sur la fluorescence chlorophylle
La mesure de la fluorescence de la chlorophylle a été effectuée in vivo à l’aide d’un dispositif d’imagerie vidéo FluorCam FC 800 (Photon Systems Instruments).


Ce système de culture fermé permet un contrôle très fin des différents paramètres qui régulent la croissance des microalgues, la température, l’intensité lumineuse, le pH, la vitesse d’agitation et le débit de dioxyde de carbone.
Nous disposons de quatre bioréacteurs autoclavables d’un volume utile de 1 litre (BIOSTAT® Aplus, Sartorius Stedim Biotech) pour la culture des microalgues. Ce dispositif permet de contrôler des paramètres tels que la température, le pH, la vitesse d’agitation, le débit de gaz de culture et l’intensité lumineuse.
Une sonde anti-débordement et une pompe péristaltique pour l’ajout de milieu permettent des cultures en continu. Le système d’éclairage réalisé dans le laboratoire permet de réguler l’éclairage entre 30 et 1500 µmol photon/m2/s (PAR). Ces bioréacteurs sont contrôlés depuis un ordinateur avec le logiciel PC Panel µDCU.

Pour étudier, in vivo, les paramètres déterminant l’efficacité de conversion de l’énergie solaire par photosynthèse, la plateforme dispose de techniques non invasives de spectroscopie optique
Dual Pam : Ce dispositif basé sur une lumière d’analyse modulée permet de suivre en temps réel la fluorescence de la chlorophylle du photosystème II et l’absorption du centre de réaction du photosystème I. Il permet d’estimer le rendement de conversion de l’énergie lumineuse dans ces deux photosystèmes.
Il permet d’estimer le rendement de conversion de l’énergie lumineuse dans ces deux photosystèmes.
JTS10 (Joliot-type spectrophotometer) : Ce spectromètre mesure les variations d’absorption des pigments et des transporteurs d’électrons de la chaîne photosynthétique. La mesure se fait à partir de flashs de l’ordre de la microseconde, elle permet une résolution cinétique fine des différents événements de transfert d’électrons contribuant à la photosynthèse.
Souches stockées à l’EBM :
Une collection de près de 500 souches de microalgues et de cyanobactéries, sauvages ou transformées, est conservée dans la cryobanque de l’équipe EBM hébergeant la plateforme Heliobiotec :
Mutants d’insertion de Chlamydomonas reinhardtii créés en laboratoire
Souches de C. reinhardtii exprimant des gènes d’intérêt vers le haut ou le bas
Souches mutantes de Synechocystis PCC6803
Diverses espèces de microalgues provenant de collections du monde entier (CCAP, UTEX, SAG, Duke Center, etc.)
Conservation des souches
La conservation des microalgues se fait par congélation à une température inférieure à -180°C dans des cryoconservateurs en azote liquide. Cette méthode de conservation a été choisie pour éviter la dérive génétique qui peut se produire après trop de transplantations sur gélose.
Gestion des souches :
Le logiciel LabCollector est utilisé pour la gestion des souches à l’EBM.
Ce logiciel nous permet, entre autres, de gérer deux étapes importantes dans la conservation des souches :
La traçabilité des opérations.
La planification des contrôles de viabilité périodiques
Lors des contrôles de viabilité, des tests de non-contamination sont également réalisés.
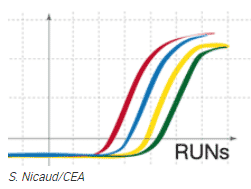
Objectif : Comparer l’évolution de différents gènes d’intérêt pour la production de biocarburants ou de molécules biosourcées pour la chimie verte, les cosmétiques, les produits pharmaceutiques et les nutraceutiques.
La plateforme HelioBiotec est équipée d’un LightCycler 480 (Roche Diagnostics) qui nous permet de réaliser la quantification des gènes en temps réel.
Il s’agit de la fusion de deux technologies :
PCR : réaction en chaîne par polymérase permettant l’amplification de l’ADN.
Quantification (relative ou absolue) du signal fluorescent produit.
Le but est de comparer l’évolution de différents gènes d’intérêt. Cette comparaison est normalisée par des gènes témoins (stables dans toutes les conditions). Les analyses peuvent être réalisées dans des plaques de 96 ou 384 puits.
Cet appareil permet également le génotypage avec le module HRM (High Resolution Melting). Cette technique permet, par exemple, de séparer 2 populations de variants pour une seule base (acide nucléique) dans un gène donné. Elle combine les mêmes technologies que ci-dessus mais avec une meilleure résolution.

Responsable et contact de la plateforme
Mots clés
alcanes et alcènes ; glycérolipides: phospholipides ; hydrocarbures ; pigments ; polyesters lipidiques ; cires de plantes ; acides gras dicarboxyliques