Vous êtes ici : Accueil Cité des Énergies > ACCUEIL BIAM > Recherche > PEPSS > Thèmes de recherche PEPSS
Thèmes de recherche
Stress oxydant et réponses non-stomatiques au stress hydrique

De nombreuses conditions de stress environnemental inhibent la photosynthèse des plantes, entraînant la production d’espèces réactives de l’oxygène dans les chloroplastes et provoquant l’oxydation de macromolécules. Nous avons identifié des produits d’oxydation du caroténoïde β-carotène générés dans des conditions de stress photooxydant, tels que le β-cyclocitral (β-CC) et l’acide β-cyclocitrique (β-CCA), qui agissent comme des molécules de signalisation déclenchant des changements dans l’expression de gènes nucléaires et améliorant la tolérance au stress des plantes (Havaux 2021). Par exemple, l’arrosage de plantes d’Arabidopsis avec une solution de β-CCA augmente très nettement leur tolérance à la sécheresse (D’Alessandro et al. 2019). Ce phénomène n’est pas attribuable à une modification du fonctionnement des stomates, et nos travaux actuels sont centrés sur l’élucidation des voies de signalisation induites par le β-CC(A) et les mécanismes qui sous-tendent la tolérance accrue à la sécheresse. Dans ce contexte, nous essayons d’identifier les gènes clés dans les voies de signalisation β-CC(A) en combinant des analyses transcriptomiques, des cribles génétiques et des études de mutants d’Arabidopsis. Nous avons d’ores et déjà isolé un certain nombre de mutants ne répondant pas au β-CC et séquencé le génome de quelques-uns d’entre eux, fournissant plusieurs gènes candidats impliqués dans la signalisation du β-CC. De plus, un travail de recherche translationnelle est en cours, dans lequel les informations recueillies chez Arabidopsis sont transférées chez des espèces agronomiques, comme la vigne (en collaboration avec deux laboratoires de l’INRAE, SVQV Colmar et LPSE Montpellier). Ce travail fournira les bases pour l’utilisation pratique du β-CCA comme phytoprotecteur en vue d’améliorer la tolérance à la sécheresse des cultures.
Les apocaroténoïdes induits par le stress dans la régulation de la croissance et la communication plante-plante
Un effet majeur du β-CC(A) est d’induire des mécanismes de défense au détriment de la croissance et du développement (Ramel et al. 2012). En conséquence, il a été constaté que l’arrosage de plantes d’Arabidopsis avec du β-CCA inhibait la croissance des racines. Nous avons identifié des gènes qui sont induits par le β-CCA et qui jouent un rôle dans cette inhibition de la croissance racinaire. Le lien avec la tolérance à la sécheresse est actuellement étudié par la surexpression constitutive de ces gènes chez Arabidopsis.
Contrairement au β-CCA, le β-CC est un composé volatil qui pourrait potentiellement servir de signal dans la communication entre plantes (Havaux 2021). Cette signalisation à longue distance du β-CC et d’autres apocaroténoïdes volatils est actuellement étudiée chez Arabidopsis et la tomate sous différentes conditions environnementales dont l’ombrage créé par la végétation dans des agrosystèmes de cultures intercalaires.
Signalisation des cellules de garde en réponse au stress hydrique
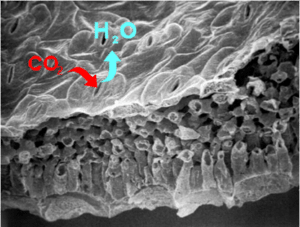
Chez les végétaux, les cellules de garde sont des cellules spécialisées qui délimitent et con trôlent l’ouverture/la fermeture du pore du stomate régulant les échanges gazeux (CO2 et H20) entre la plante et l’atmosphère. Le contrôle de l’ouverture des stomates par les cellules de garde influence directement la photosynthèse et la transpiration et, par conséquent, la production de biomasse des plantes. Depuis plusieurs années, nous développons et adaptons des approches interdisciplinaires et de biologie des systèmes aux cellules de garde qui sont désormais un système modèle clé pour l’étude de la transduction des signaux et les fonctions des canaux ioniques chez les plantes.
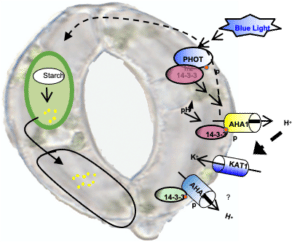
Au niveau de la membrane plasmique des cellules de garde, un des acteurs majeurs de la régulation stomatique est l’activité des pompes H+ qui créent le potentiel électrochimique nécessaire à l’entrée du K+. Afin de déterminer les rôles de cette famille de transporteurs et leur régulation dans les cellules de garde, plusieurs ressources génétiques sont développées et exploitées. L’identification et la caractérisation de ces mécanismes fins de régulation des voies de signalisation des cellules de garde offrent une des stratégies originales pour améliorer la résistance des cultures au stress hydrique.
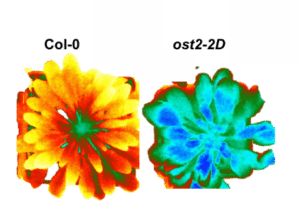
Les H+-ATPases au service des Phytotechnologies (PI : N. Leonhardt)

Les rôles pléiotropes des H+-ATPases de la membrane plasmique sont également illustrés par leur impact sur l’absorption des ions via la régulation du potentiel membranaire ou l’efflux de H+ modulant les propriétés physico-chimiques de la rhizosphère. Suite aux travaux réalisés dans le cadre du projet PIA-DEMETERRES (2016-2021), nous avons mis en évidence que les mécanismes d’absorption du césium par la plante dépendent de multiples paramètres dont les propriétés physico-chimiques du sol et l’état physiologique des plantes. Le césium est un métal alcalin faiblement hydraté dont les propriétés chimiques sont proches de celles du potassium, il est admis que le Cs pénètre dans les plantes principalement via les systèmes de transport du K+ dédiés à la nutrition des plantes. L’identification et la caractérisation de ces transporteurs sont actuellement étudiées en collaboration avec plusieurs partenaires académiques et industriels. Par ailleurs, les paramètres rhizosphériques à l’interface sol/racine et leur modification par le système racinaire sont cruciaux dans l’absorption du Cs. En particulier, l’architecture, la plasticité et l’activité de transport des racines peuvent modifier le pH du sol affectant la biodisponibilité du césium et son absorption par les plantes. Dans ce contexte, l’identification et la modification de l’activité des principales ATPases de pompage de protons sont actuellement étudiées afin d’augmenter (phytoremédiation) ou de limiter (phytostabilisation) l’absorption du césium en modulant la disponibilité du Cs dans la rhizosphère et/ou en régulant les systèmes de transport racinaire pour l’absorption du Cs.

https://www.youtube.com/watch?v=LzO-I5DfL5U
Responsable d’équipe : Nathalie LEONHARDT
Mots clés
Stress hydrique; Génétique; Arabidopsis thaliana; Métaux lourds; Stomate; Transporteurs; Transduction du signal; Croissance; Photosynthèse; stress oxydant