Vous êtes ici : Accueil Cité des Énergies > ACCUEIL BIAM > Recherche > PPV accueil > Thèmes de recherche PPV
Thèmes de recherche
Etude des rôles physiologiques des réductases à thiol, enzymes contrôlant l’état redox de partenaires protéiques, dans les réponses des végétaux aux variations de l’environnement
Les espèces réactives de l’oxygène induisent des modifications post-traductionnelles qui peuvent être associées à des changements d’activité et de conformation des protéines. Ces modifications sont généralement irréversibles, sauf pour la cystéine et la méthionine, dont l’état redox est régulé par des réductases à thiol de types thiorédoxines, glutarédoxines, peroxyrédoxines et méthionine sulfoxyde réductases.
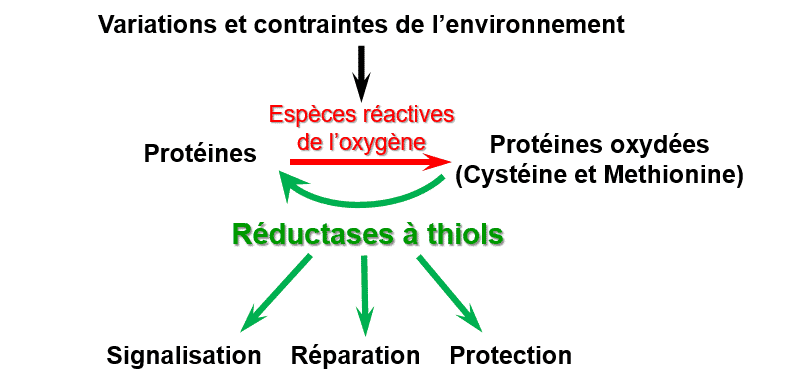
Figure 1 : Fonctions des réductases à thiol dans les réponses des végétaux aux variations et contraintes de l’environnement.
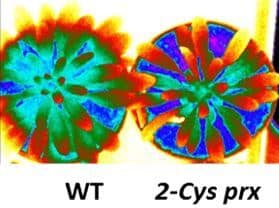
Ces enzymes, en contrôlant l’état redox de protéines cibles, jouent des rôles clés dans des mécanismes de protection et de réparation des structures photosynthétiques lors de contraintes environnementales, comme nous l’avons montré pour la thiorédoxine CDSP32 et les méthionine sulfoxyde réductases B1 et B2 (Photo 1).

Nous avons aussi mis en évidence l’implication de glutarédoxines (GRXS14 et GRXS17) dans des voies de signalisation liées aux conditions lumineuses (Photo 2).

Photo 2 : Développement floral de plantes d’Arabidopsis de types sauvage (à gauche) et déficiente en GRXS17 (à droite) sous photopériode longue (16 h). © CEA/BIAM P. Rey
Des travaux en cours visent à caractériser les fonctions des réductases à thiol dans le fonctionnement des stomates, pores entourés de deux cellules de garde ayant la capacité de changer de volume selon les conditions environnementales. Les stomates permettent les échanges gazeux à la surface des feuilles et conditionnent ainsi l’activité photosynthétique et la croissance des végétaux. Par une approche protéomique, nous avons montré que de nombreuses réductases à thiol sont abondantes dans les cellules de garde. Par ailleurs, la conductance stomatique est altérée en conditions optimales de croissance dans des lignées d’Arabidopsis déficientes en peroxyrédoxines ou glutarédoxines plastidiales (Photo 3), et ces lignées présentent une sensibilité accrue à l’acide abscissique et au peroxyde d’hydrogène, messagers hormonaux et rédox induisant la fermeture des stomates.
L’ensemble de ces données révèle que des mécanismes de transmission impliquant des thiols protéiques jouent un rôle essentiel dans le réseau de signalisation contrôlant les mouvements des stomates.
L’objectif de nos travaux actuels est de poursuivre la caractérisation des fonctions physiologiques des réductases à thiols plastidiales et de leurs partenaires dans les réseaux de signalisation régulant l’activité photosynthétique et les mouvements des stomates en fonction des stimuli environnementaux.
Contact : Pascal REY
Caractérisation du rôle protecteur de l’appareil photosynthétique exercé par les lipocalines
Figure 1 : Lipocaline © CEA/BIAM D. Rumeau
Les lipocalines sont de protéines ubiquitaires dont la structure tertiaire conservée, permet de lier de petites molécules hydrophobes. Les lipocalines animales, très étudiées, assurent diverses fonctions essentielles associées à la nature du ligand qu’elles fixent (lipides, peptides stéroïdes, métabolites secondaires…). Ainsi, elles participent au transport de molécules, à la régulation de processus développementaux, à la transduction de signaux et à la réponse aux stress.
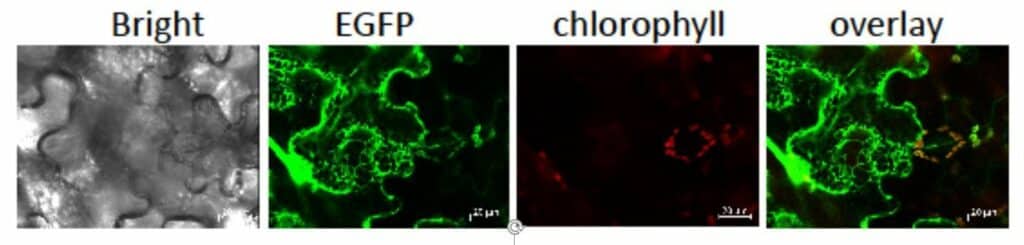
Photo 1 : Localisation de LCNP. Des feuilles de Nicotiana benthamiana ont été infiltrées par Agrobacterium pour l’expression transitoire du gène APO-EGFP. Les observations ont été effectuées 6 jours plus tard par microscopie confocale.
Toutes deux ont été associées aux mécanismes de réponse et de tolérance aux stress (Photo 2), cependant les mécanismes moléculaires qui sous-tendent ces fonctions ne sont pas connus.
Nous nous intéressons en particulier à LCNP qui prévient la peroxidation lipidique et l’accumulation de lipides oxydés contribuant ainsi à la capacité des plantes à supporter un stress oxydant.

De plus, il est à présent établi que LCNP participe à une forme de dissipation non-photochimique de l’énergie lumineuse et participe ainsi à la protection de l’appareil photosynthétique (Figure 2, collaboration M Havaux (SAVE, BIAM) et A Malnoë (Umea University, Suède).
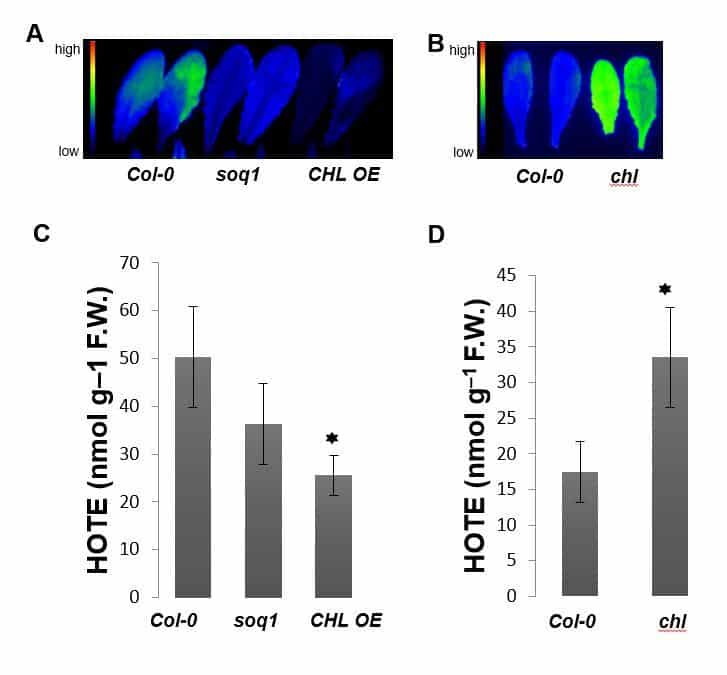
Nos travaux visent à élucider les mécanismes moléculaires associés à ces fonctions de protection, et en particulier à identifier les molécules associées à CHL dans le chloroplaste.
Dans les cellules de garde, l’activité d’une lipoxygénase contribue à l’alkylation d’une protéine kinase et provoque ainsi la fermeture des stomates induite par des stress biotiques
Nous explorons également dans notre équipe, une voie de signalisation qui contribue à l’immunité innée des plantes. Cette voie implique le stress oxydant et notamment une lipoxygénase présente dans les cellules de garde.
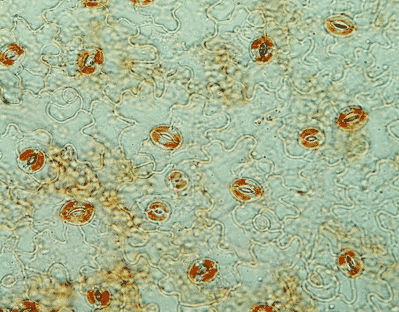
Photo 1 : Epiderme foliaire d’Arabidopsis (coloration au rouge neutre) © CEA/BIAM J-L. Montillet
Dans la mesure où les cellules de garde (Photo 1) contrôlent une part importante des échanges gazeux nécessaires à la photosynthèse, un autre objectif de notre projet scientifique est de comprendre comment les menaces physiques et biologiques peuvent interférer avec cette fonction importante chez les plantes. Chez Arabidopsis, l’inoculation des feuilles de la plante par la bactérie Pseudomonas syringae, est suivie de l’activation de la lipoxygénase 1 (LOX1), présente dans les cellules de garde. Cette enzyme participe à la production d’oxylipines réactives qui déclenchent la fermeture des stomates. Nous étudions cette voie de signalisation originale de la cellule de garde qui permet d’empêcher la pénétration de l’agent pathogène et la colonisation de la plante.
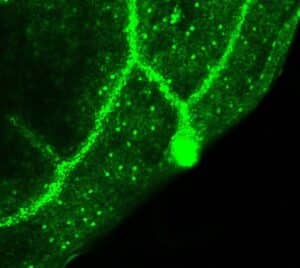
Photo 2 : Localisation de la fluorescence eGFP dans des plants transgéniques exprimant le promoteur de RRPK1 en amont du gène rapporteur eGFP. La fluorescence est essentiellement localisée dans les stomates, organes conducteurs et hydathodes. © CEA/BIAM D. Rumeau
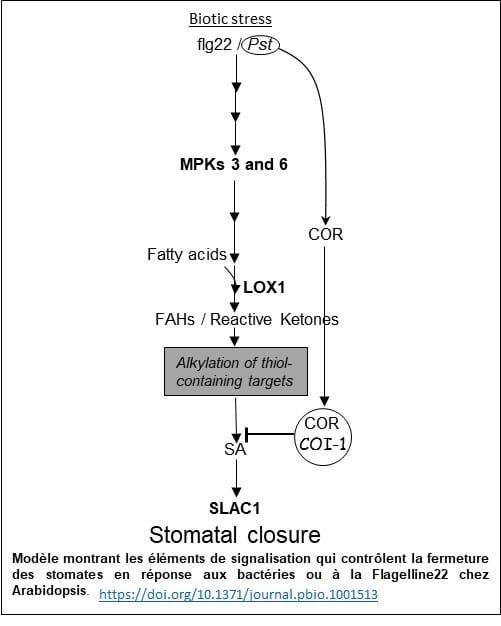
Une approche de chimie « click » nous a permis d’identifier une sérine-thréonine protéine kinase qui est localisée dans les stomates (Photo 2) et joue un rôle crucial dans cette voie de signalisation. Le mécanisme par lequel cette protéine kinase opère dans ce phénomène de défense est en cours d’élucidation (Modèle).
Contact : Jean-Luc MONTILLET jean-luc@montillet@cea.fr

Responsable d’équipe Pascal REY
Mots clés
Plantes supérieures, contraintes environnementales, réponses au stress, chloroplaste, photosynthèse, protéines, lipocaline, réductases à thiol, oxydoréduction, signalisation, stomates.