Vous êtes ici : Accueil Cité des Énergies > ACCUEIL BIAM > Recherche > LGBP > Thèmes de recherche LGBP
Thèmes de recherche
Nos Objectifs
Stefano CAFFARRI, Rainer HIENERWADEL, Colette Jungas, Quentin CHARRAS (PhD).
Une particularité des organismes photosynthétiques réside dans leur capacité à utiliser l’énergie solaire pour produire des composés organiques complexes à partir des molécules inorganiques simples. En particulier, le Photosystème II et le Photosystème I sont des enzymes importantes au niveau desquelles l’absorption de la lumière et les premières étapes de sa conversion en énergie chimique ont lieu. En raison de la nature sessile des plantes, leur appareil photosynthétique doit s’adapter de façon efficace à des changements environnementaux rapides comme les fluctuations et la qualité de la lumière incidente. Nous développons une approche pluridisciplinaire dans les domaines de la biochimie, biologie moléculaire et des méthodes spectroscopiques statiques et cinétiques pour mieux comprendre les structures particulières et la fonction de ces photosystèmes. Notre objectif également est de préciser les adaptations structurales à différentes conditions de lumière et les mécanismes de défense lors de conditions de stress comme la très forte lumière. Pour cela nous utilisons les différents modèles d’organismes photosynthétiques présents au laboratoire (Arabidopsis, Chlamydomonas,
Physcomitrella, Posidonia et bactéries photosynthétiques).
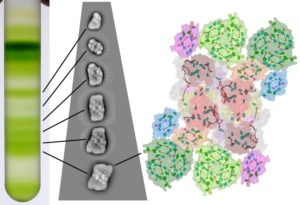
Purification du Photosystème II par ultracentrifugation de membranes solubilisées sur un gradient de saccharose. Les supercomplexes du Photosystème II avec une taille différente du système antennaire migrent à des positions différentes et ils ont été visualisés par des techniques de microscopie électronique – Crédit : Stefano CAFFARRI/ AMU
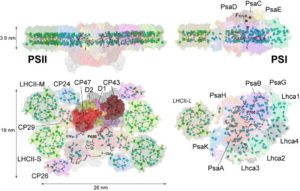
Modèles des structures des supercomplexes du Photosystème II et du Photosystème I vus du côté latéral et lumenal. Des sous-unités clés du core du PSII (D1, D2, CP47 et CP43) et ses complexes du système antennaire (LHCII, CP24, CP26 and CP29), et des sous-unités du PSI (PsaA-B-C-D-E-G-H-K) et son système antennaire (Lhca1-4 et LHCII) sont indiqués. La position de la plupart des chlorophylles et des caroténoïdes est indiquée (pour les détails, regarder Caffarri et al. Curr. Protein Pept. Sci., 2014) – Crédit : Stefano CAFFARRI/ AMU
Nos axes de recherche
- Structure et organisation des photosystèmes de plantes: Purification et analyse structurale du centre réactionnel, des cores complexes et supercomplexes des photosystèmes I et II.
- Transfert d’électron et de protons dans le photosystème II: techniques de spectroscopie IRTF différentielle induite par la lumière ou par électrochimie et de spectroscopie UV-VIS résolue en temps (nanoseconde).
- Photoprotection des photosystèmes: régulation de transitions d’état ; rôle de la protéine PsbS ; rôle photoprotecteur des caroténoïdes dans les photosystèmes et dans les systèmes antennaires isolés.
Publications Pubmed : ici
Régulation du chloroplaste : Rôle et mécanismes moléculaires de la signalisation du ppGpp chez les plantes et les algues
Chez les bactéries, les nucléotides guanosine pentaphosphate et tétraphosphate hyperphosphorylés [désignés ensemble sous le nom de ppGpp] orchestrent une cascade de signalisations qui régule la croissance dans des conditions optimales et en réponse au stress environnemental. La ppGpp est également présente dans les chloroplastes des plantes et des algues où il a été démontré qu’elle s’accumule en réponse au stress abiotique. Des études de notre groupe ont montré que la ppGpp est un inhibiteur de l’expression des gènes du chloroplaste qui est conservé au cours de l’évolution et qui peut réguler la photosynthèse, la remobilisation des nutriments, la croissance et l’immunité chez les plantes et les algues (pour une revue, voir Field 2018). Cependant, de nombreuses questions subsistent sur le fonctionnement de la signalisation de la ppGpp et son intégration dans les voies de signalisation connues de la croissance et du stress.
Nos recherches actuelles et futures se concentrent sur l’élucidation du rôle physiologique (à quoi sert-il ?) et des mécanismes moléculaires (comment fonctionne-t-il ?) de la signalisation ppGpp. Nous travaillons principalement sur la plante modèle Arabidopsis thaliana où nous utilisons des approches de génétique moléculaire, de physiologie végétale et de biochimie pour répondre à ces questions. Nous développons aussi activement de nouvelles techniques de biologie cellulaire et de biologie synthétique pour accélérer nos efforts de recherche. Nos travaux révèleront les rôles que la signalisation ppGpp semble jouer à l’intersection des flux de nutriments et d’énergie dans les organismes photosynthétiques.
Chercheurs impliqués :
Ben Field, Patrice Crété, Benoit Menand, Stefano Caffarri, Christophe Robaglia, Stefano D’Alessandro (visiting scientist), Shanna Romand (PhD), Marwa Mehrez (PhD, visiting), Florent Velay (PhD)
Financement : CHLORO_SAP ANR, SIGNAUX_BIONRJ, SIGNAUX_BIONRJ ANR, G4PLAST ANR
Sur Twitter : @Ben_Field_1, @StefanoDAless11, @RomandShanna
Romand S, Abdelkefi H, Lecampion C, Belaroussi M, Dussenne M, Ksas B, Citerne S, Caius J, D’Alessandro S, Fakhfakh H, Caffarri S, Havaux M, Field B* (2022) A guanosine tetraphosphate (ppGpp) mediated brake on photosynthesis is required for acclimation to nitrogen limitation in Arabidopsis. Elife 10.7554/eLife.75041 Fait marquant
Harchouni S, England S, Vieu J, Romand S, Aouane A, Citerne S, Legeret B, Alric J, Li-Beisson Y, Menand B* and Field B* (2022), Guanosine tetraphosphate (ppGpp) accumulation inhibits chloroplast gene expression and promotes super grana formation in the moss Physcomitrium (Physcomitrella) patens. New Phytol. https://doi.org/10.1111/nph.18320
Avilan, L., Lebrun, R., Puppo, C., Citerne, S., Cuiné, S., Li‐Beisson, Y., Menand, B., Field*, B. and Gontero*, B. (2021), ppGpp influences protein protection, growth and photosynthesis in Phaeodactylum tricornutum. New Phytol, 230: 1517-1532. https://doi.org/10.1111/nph.17286
Régulation nucléaire : rôle de la Topoisomérase VI dans la réponse au stress basée sur la chromatine et la transcription
Chez les plantes, la plupart des contraintes environnementales aboutissent à un stress oxydatif provenant du chloroplaste. Un crible génétique de mutants affectés dans la réponse au stress oxydatif nous a permis d’identifier la topoisomérase VI comme un élément clé de la réponse ; cette découverte a mis en évidence l’importance du contrôle chromatinien de la réponse des plantes au stress oxydatif (Šimková et al, 2012). Les topoisomérases peuvent réguler l’expression des gènes en permettant des changements de conformation de l’ADN et de la chromatine, rendant la chromatine précédemment condensée accessible à la machinerie transcriptionnelle et aux facteurs de transcription. Les analyses de l’expression génique à l’échelle du génome ont révélé que Topo VI est nécessaire non seulement pour l’activation complète des transcrits sensibles au stress oxydatif, mais aussi pour l’extinction transcriptionnelle des éléments transposables et pour le maintien de l’expression des gènes péricentromériques. Des analyses de la chromatine à l’échelle du génome ont en outre révélé que la Topoisomérase VI participe à une fonction de type isolatrice qui empêche la propagation de l’hétérochromatine dans des îlots d’euchromatine (Méteignier et al, bioRxiv). Nous avons également identifié de nouveaux interacteurs du complexe Topo VI qui fournissent des pistes sur les mécanismes possibles par lesquels Topo VI peut agir comme régulateur de l’expression des gènes et exercer une fonction de type isolatrice nécessaire qui permet de maintenir la partition du génome en différents domaines chromatiniens aux fonctions bien distinctes, i.e. soit répressifs, soit permissifs pour la transcription des gènes.
Chercheurs impliqués :
Christophe Laloi, Cécile Lecampion, Florent Velay (PhD)
Financement : SLOSAM ANR, ADASOX, CHROS ANR.
Publications sélectionnées :
Méteignier LV, Lecampion C, Velay F, Vriet C, Dimnet L, Térèse M, Rougée M, Breuer C, Soubigou-Taconnat L, Sugimoto K, Barneche F and Laloi C (2022) Topoisomerase VI participates in an insulator-like function that prevents H3K9me2 spreading into euchromatin islands. PNAS 119 (27) e2001290119 https://doi.org/10.1073/pnas.2001290119
Bourbousse C, Barneche F and Laloi C (2020) Plant Chromatin Catches the Sun. Front. Plant. Sci. 10(1728). doi: 10.3389/fpls.2019.01728.
Simkova, K., Moreau, F., Pawlak, P., Vriet, C., Baruah, A., Alexandre, C., Hennig, L., Apel, K. And Laloi, C. (2012) Integration of stress-related and reactive oxygen species-mediated signals by Topoisomerase VI in Arabidopsis thaliana. Proc. Natl. Acad. Sci. USA 109(40), 16360-16365. doi:10.1111/j.1365-313X.2011.04825.x.
LGBP : Benoît Menand, Marie-Hélène Montané, Christophe Robaglia, Cécile Lecampion, Romain Perdoux, Ben Field, Stefano d’Alessandro
Collaborations : Christian Meyer (INRAe, Versailles) Lyubov Ryabova (CNRS, IBMP Strasbourg), Jean-Luc Gallois (INRAe, Avignon), Brigitte Gontero (CNRS, IMM, Marseille), Thierry Desnos (BIAM/SAVE), Yonghua Li-Beisson (BIAM/EBM), Fabien Nogué (INRAe Versailles)
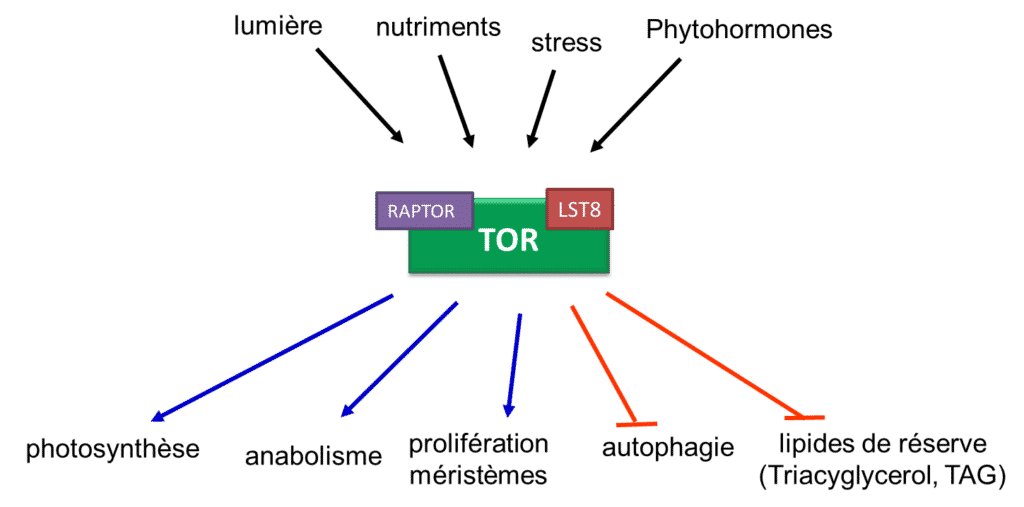
Figure 1. Principales fonctions connectées à la voie de signalisation de TOR chez les plantes (B. Menand/CNRS)
Objectifs :
L’adaptation des plantes à leur environnement nécessite une régulation fine du métabolisme et des processus de croissance par des voies de signalisation hautement connectées. La voie de signalisation impliquant la kinase TOR (Target Of Rapamycin) est conservée au cours de l’évolution des eucaryotes et joue un rôle central dans la régulation de la réponse à l’ensemble des perceptions environnementales allant des carences nutritives diverses à la réponse aux pathogènes. C’est donc un modèle pur d’étude de l’intégration des multistress chez les plantes, un enjeu majeur pour l’agriculture (Fig 1.).
Notre objectif est d’identifier de nouvelles composantes de la voie de signalisation TOR chez les plantes (en particulier la plante modèle Arabidopsis thaliana) afin de comprendre comment cette voie de signalisation ancestrale a intégré des spécificités des plantes, telles que la photosynthèse, au cours de l’évolution. Nous travaillons également sur des algues afin de comprendre comment la modulation de cette voie de signalisation peut améliorer la productivité en Triacylglycérols (TAG), des lipides de réserve précurseurs de biocarburants.
Principaux faits marquants
Afin d’identifier de nouveaux éléments de la voie de signalisation TOR, nous avons réalisé un crible pharmacogénétique. Il s’agit de sélectionner des mutants d’Arabidopsis qui sont soit hypersensibles, soit résistants à l’inhibition de TOR. Pour cela, nous utilisons des inhibiteurs ATP compétitifs de TOR dont nous avons montré la sélectivité chez les plantes (Fig 2 et 3.).

Figure 2. Inhibition dose-dépendante de la croissance des plantes par AZD-8055, un inhibiteur ATP-compétitif sélectif de TOR. Des plantes d’Arabidopsis thaliana de 3 jours ont été transférées sur du milieu contenant l’inhibiteur puis ont poussé pendant 6 jours. Photos des plantes ayant poussé verticalement à la surface du milieu (partie supérieure) et de la partie aérienne (partie inférieure) sur AZD-8055. Crédit : B. Menand/CNRS and M.-H. Montané/CEA, J ; Exp. Bot. 2013
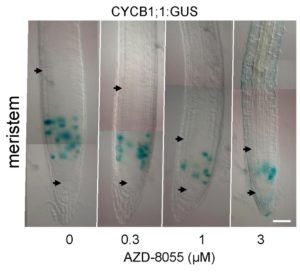
Figure 3. Un inhibiteur du site actif de TOR (AZD-8055) réduit la taille du méristème racinaire et de la zone de prolifération mais pas la durée de la phase G2 du cycle cellulaire. Photos de pointes racinaires en microscopie DIC avec la zone méristématique délimitée par les flèches. L’expression de la CYCB1;1::GUS (en bleu) marque les cellules en phase G2 du cycle cellulaire. Crédit : B. Menand/CNRS
and M.-H. Montané/CEA
Cette stratégie nous a permis d’identifier une cible en aval de TOR, la DYRK kinase YAK1 comme un régulateur essentiel de l’activité du méristème. (Fig. 4). Nous avons constaté que les mutants perte de fonction yak1 sont résistants à l’inhibition de TOR parce que YAK1 est un intermédiaire essentiel de la régulation dépendante de TOR du cycle cellulaire qui bloque ainsi la prolifération cellulaire.
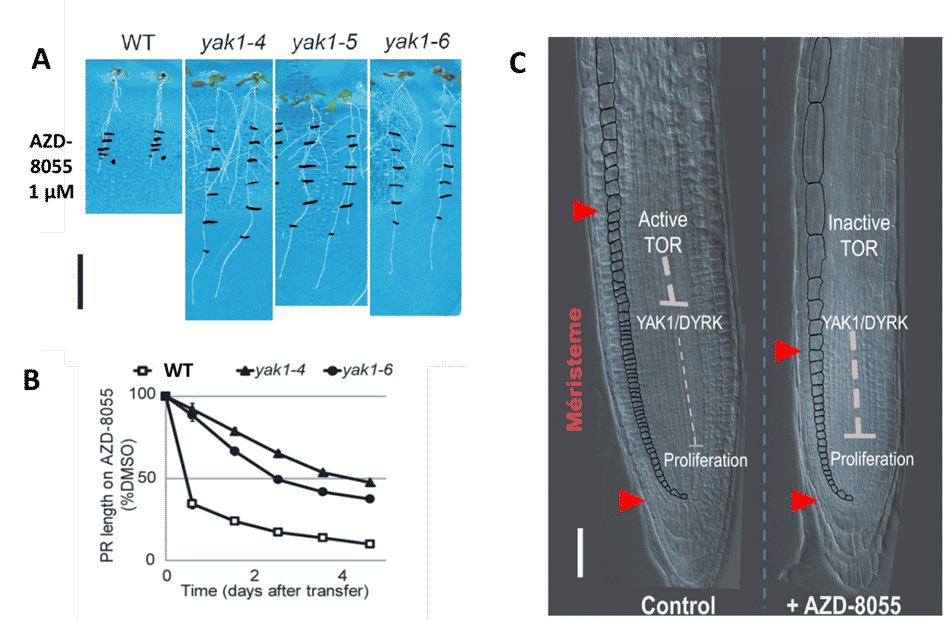
Figure 4. Représentation schématique du rôle de l’axe TOR-YAK1 dans la régulation de l’activité méristématique. B. Menand/CNRS, d’après Barrada et coll.., Development 2019. YAK1 est un répresseur de la prolifération cellulaire dans le méristème. Lorsque TOR est active, elle inhibe YAK, ce qui favorise la prolifération et la croissance alors que lorsque TOR est inhibée, YAK1 devient active et bloque les divisions cellulaires.
D’autre part, nous avons montré que la productivité en TAG par des algues, traitées avec une dose d’inhibiteur de TOR qui ne bloque pas la prolifération cellulaire, était 3 à 4 fois plus élevée que chez des algues carencées en azote (Fig.5 ; Prioretti et al 2017). Cette augmentation de la productivité lipidique est associée à un ralentissement modéré de la prolifération et contrôlée par une inhibition partielle de TOR. Ces conditions constituent un régime «get-fat growth» permettant croissance et division cellulaire en accumulant des TAG. Ceci démontre que la modulation de la voie de TOR permet d’ augmenter la productivité cellulaire en TAG.
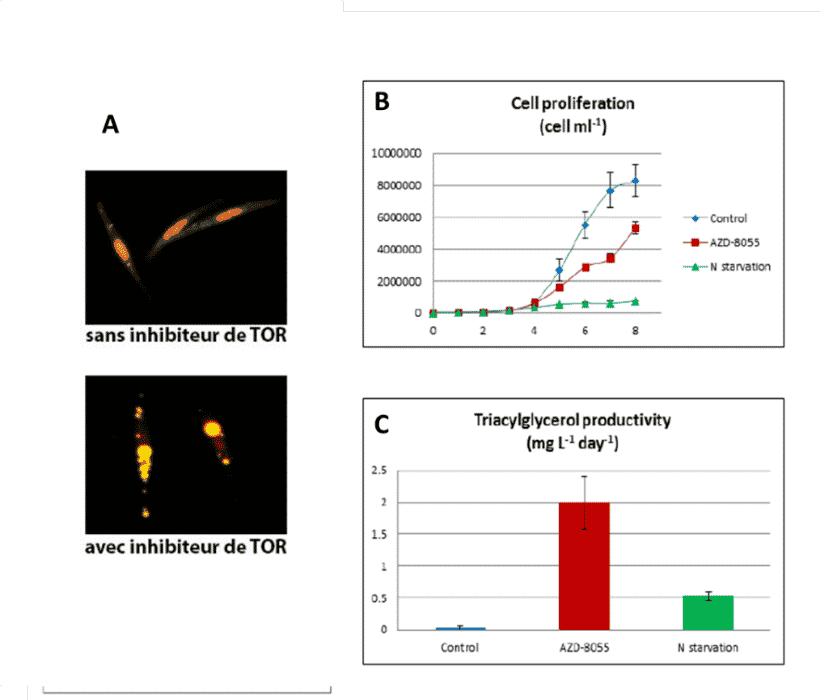
Figure 5: Accumulation de gouttelettes lipidiques et productivité en lipides de réserves, des Triacyglycerols, (TAG) par des diatomées P. tricornutum traitées avec 2 µM de l’inhibiteur de TOR AZD-8055, une concentration qui réduit la prolifération de 50%. A, Gouttelettes lipidiques révélées avec un marqueur fluorescent. B, Effet de l’inhibiteur de TOR à une concentration contrôlée donnant une vitesse de la prolifération cellulaire réduite de moitié, comparé à une carence en azote qui bloque complétement la croissance. C, Effet sur la productivité en TAG des conditions décrites en B. D’après Prioretti et coll., Algal Research 2017.
Perspectives
Nous poursuivrons l’analyse de nouveaux mutants isolés par le crible pharmacogénétique afin de mieux comprendre le fonctionnement de la voie de TOR chez les plantes. Lors de nos analyses futures, nous distinguerons notamment les fonctions de TOR associées à la prolifération cellulaire de celles associées à la physiologie et notamment la photosynthèse en nous intéressant par exemple aux mécanismes de signalisation noyau- chloroplastique (lien vers thème de recherche 1). Nous venons récemment d’assurer le financement d’un nouveau projet ANR (TOR-DYRKcontol lien vers le projet) qui vise à décrypter les interactions entre les kinases TOR et DYRK dans le contrôle de la croissance et la synthèse des lipides chez les plantes et les algues. L’utilisation à la fois de plantes et d’algues nous permettra de transférer des connaissances d’une espèce à l’autre, ce qui devrait également éclairer les aspects évolutifs de la signalisation de TOR. De plus, nous nous intéressons au rôle de la voie de TOR dans la mise en place de résistance des plantes à certains virus dans un contexte d’ applications agronomiques (Ouibrahim et al 2015).

Responsable d’équipe Stefano CAFFARRI
Responsables adjoints Ben FIELD et Benoît MENAND
Mots clés
Bioénergie, photosynthèse, photosystème, réponse à la lumière et au stress, voie de signalisation, arabidopsis, Chlamydomonas, Physcomitrella, Posidonia, transfert d’électrons et de protons, régulation du chloroplaste, signalisation du ppGpp, Topoisomérase, chromatin, lipide de réserve, voie de signalisation de TOR, MoBIFC, rapamycine, plantes, croissance, photosymbiose.